Manchmal kann ein radioaktiver Schaden gar nicht groß genug sein – wenn es nämlich darum geht, Tumorgewebe mit ionisierender Strahlung zu zerstören. In der Strahlentherapie kommen daher Substanzen zum Einsatz, die den Strahlenschaden im Tumorgewebe gezielt verstärken. „Der intermolekulare Coulombzerfall, den wir gefunden haben, könnte helfen, solche Sensibilisatoren wirkungsvoller zu machen“, sagt Alexander Dorn, Forschungsgruppenleiter in der Abteilung Pfeifer am MPIK, der an der aktuellen Studie maßgeblich beteiligt war. Die Beobachtung seines Teams könnte aber auch das Verständnis verbessern, wie künstliche oder natürliche ionisierende Strahlung das Erbgut von gesundem Gewebe schädigt.
Energieüberschuss führt zur Coulombexplosion
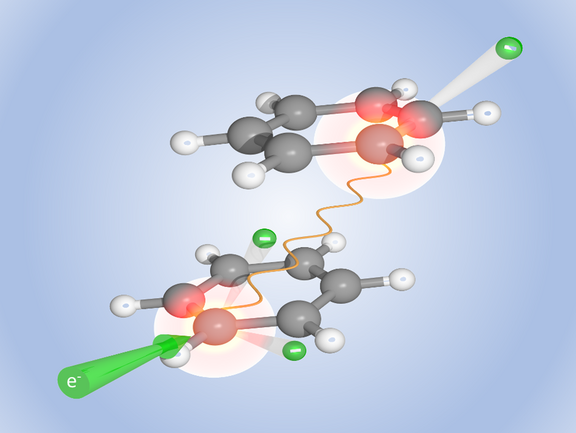
Die DNA-Doppelhelix des Genoms ähnelt einer Strickleiter mit Sprossen aus Nukleinbasen-Paaren. „Da Experimente mit den freien Nukleinbasen schwierig sind, haben wir als Modellsystem zunächst Paare von Benzolmolekülen untersucht“, erklärt Alexander Dorn. Diese Kohlenwasserstoffringe sind auf ähnliche Weise miteinander verbunden wie die in der DNA-Kette übereinandergestapelten Nukleinbasen. Die Benzolpaare beschossen die Forschenden mit Elektronen und imitierten so gewissermaßen die radioaktive Strahlung. Wenn dabei ein Elektron ein Benzolmolekül traf, wurde dieses ionisiert und mit Energie aufgeladen. Nun beobachtete das Team, dass das Molekül einen Teil dieser Energie mit hoher Wahrscheinlichkeit an sein Partnermolekül abgab. Dieser Energieschub reichte, um auch das zweite Molekül zu ionisieren, so dass nun beide Moleküle positiv geladen waren. Das ging natürlich nicht lange gut: Die beiden Molekülionen stießen sich gegenseitig ab und flogen in einer Coulombexplosion auseinander.
Bislang ging man davon aus, dass ionisierende Strahlung Biomoleküle vor allem indirekt schädigt. Die energiereiche Strahlung ionisiert nämlich auch das Wasser, aus dem eine Zelle größtenteils besteht und das Biomoleküle wie etwa die DNA umgibt. Die ionisierten Wassermoleküle, vor allem Hydroxidionen, greifen dann die DNA an. Und wenn ein Elektron der Betastrahlung oder ein Gammaquant ein DNA-Molekül mal direkt treffe, werde der Energieüberschuss stets durch Prozesse im Molekül selbst abgebaut, so dass dieses intakt bleibe – so die bisherige Annahme. Auch die schwachen Bindungen zwischen verschiedenen Molekülen oder verschiedenen Molekülteilen, wie sie in der DNA oder auch in Proteinen vorliegen, sollten davon jedenfalls nicht betroffen sein. Dass radioaktive Strahlung solche Bindungen sehr wohl aufbrechen kann, beobachteten die Wissenschaftler mit ihrem Reaktionsmikroskop. Damit können sie nicht nur die beiden auseinanderfliegenden Benzolmoleküle auffangen und deren Energie messen, sondern auch die emittierten Elektronen charakterisieren.
Fatale Folgen bei mehreren Brüchen der DNA
„Wie sich der intermolekulare Coulombzerfall auf den DNA-Strang auswirkt ist noch nicht klar“, sagt Alexander Dorn. Wenn ein einzelner Strang in der DNA-Strickleiter bricht, dürfte das nicht gravierend sein. Doch der beobachtete Mechanismus setzt auch mehrere Elektronen frei, die weitere Molekülpaare sprengen können. Und wenn in unmittelbarer Nachbarschaft beide Stränge der DNA kaputtgehen, kann das sehr wohl fatale Folgen haben.
Um die Wirkung der radioaktiven Strahlung auf das Erbgut besser abschätzen zu können, wird sein Team im Reaktionsmikroskop nun auch Paare von Nukleinbasen mit Elektronen beschießen. „Das ist experimentell anspruchsvoll, weil wir die Nukleinbasen erhitzen müssen, um sie zu verdampfen“, erklärt Dorn. „Aber bei zu großer Hitze werden sie zerstört. “ Darüber hinaus können Nuklearmediziner die Spur zu effektiveren Sensibilisatoren verfolgen, die das Team mit dem Nachweis des intermolekularen Coulombzerfalls gelegt hat. Der neue Mechanismus könnte also für beide Fälle von Strahlenschäden relevant sein: solche, die möglichst vermieden werden müssen, und solche, die möglichst groß sein sollen.
Originalpublikation:
Ultrafast energy transfer between π-stacked aromatic rings upon inner-valence ionization, Xueguang Ren, Jiaqi Zhou, Enliang Wang, Tao Yang, Zhongfeng Xu, Nicolas Sisourat, Thomas Pfeifer, and Alexander Dorn, Nature Chemistry, 20.12.2021, DOI: 10.1038/s41557-021-00838-4